Содержание
Простые эфиры и перекиси — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Министерство науки и высшего образования РФ ФГБОУ ВО
«Самарский государственный технический университет»
Химико-технологический факультет
Кафедра органической химии
Направление подготовки
18.03.01 «Химическая
технология»
04.03.02 «Химия, физика и
механика материалов»
Органическая химия
Тема: Простые эфиры и перекиси
Преподаватель: д.х.н., профессор Климочкин Ю.Н
Простые эфиры – соединения (производные спиртов и фенолов), содержащие два
углеводородных радикала, соединенных с атомом кислорода, Cnh3n+1OCmh3m+1
истинные
смешанные
ROR
h4C
O
Ch4 h4C
ROR
O
1
метоксигруппа
O
h4C
Ch4
Ch4
R-O-R¢
При R = R¢ и Ar = Ar¢ — это симметричные эфиры. При R ¹ R¢ и Ar ¹ Ar¢ — несимметричные
При R ¹ R¢ и Ar ¹ Ar¢ — несимметричные
эфиры.
Ar-O-R
Ar-O-Ar¢
23
2
Классификация
Различают:
Простые эфиры, содержащие связь Сsp3-O
– Диалкиловые и дициклоалкиловые эфиры R-O-R¢.
СН3СН2ОСН2СН3
диэтиловый эфир (этоксиэтан)
дициклогексиловый эфир
– Циклические эфиры различаются по величине цикла и числу атомов
кислорода в цикле.
Трехчленные циклы с одним О-атомом называются эпоксидами или
оксиранами. Четырехчленные – оксетанами.
Простые эфиры, содержащие связь Сsp2-O
– Алкилариловые эфиры Ar-O-R.
метоксибензол (анизол)
этоксибензол (фенетол)
– Диариловые эфиры
Ar-O-Ar’. Д ифенилоксид
– Алкилалкениловые эфиры (виниловые эфиры) С=С-OR.
33
Изомерия
Для простых эфиров характерны все виды структурной и пространственной изомерии. Изомерия углеводородной цепи и
величины радикалов.
Следует отметить, что простые эфиры относятся к спиртам как
межклассовые изомеры.
Примером межклассовых изомеров являются диметиловый эфир
СН3ОСН3 и этанол СН3СН2ОН (брутто-формула С2Н6О).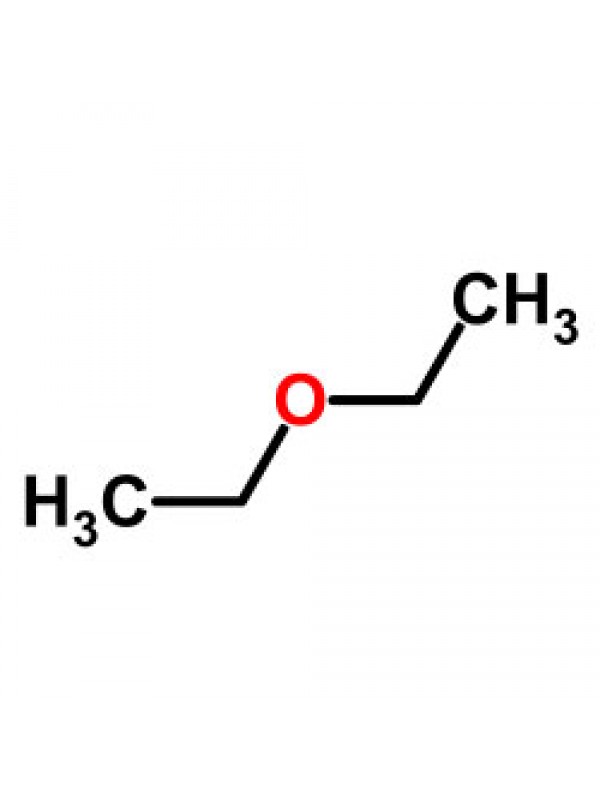
Метамерия: Ch4-O-Ch3-Ch3-Ch4 и C2H5-O-C2H5
43
Получение простых эфиров
Реакция Вильямсона (SN2):
h4C I
h4C I
h4C I
C2H5ONa + H C
3
O
ONa
— NaI
h4C O Ch4
h4C O Ch4 + 2 AgI
+ Ag2 O
O
S
+ h4C
h4C
O
Ch4
h4C
O
Ch4 +
O
O S
O Na
53
5
Получение простых эфиров
Межмолекулярная дегидратация первичных спиртов является одним
из важнейших способов получения симметричных эфиров).
Вторичные и третичные спирты в этих условиях превращаются в алкены.
C2 H5 OH + h3 SO4
O
C H OH
O S O 2 5
h4C
OH
h4C
O
Ch4
Присоединение спиртов к алкенам в присутствии кислотных
катализаторов, в том числе различных сульфокатионитов.
4. h3C
Ch4
Ch4
Ch4
+
+ CH 3OH
H
O
h4C
Ch4
Ch4
МТБЭ
63
Получение анизола:
OH
O
+ CH 2N2
Ch4
+
N2
анизол
OH
+
h4C OH
Краун-эфиры:
O
175-225оС, Al2O3
+ h3O
O
O
O
O
Ch4
O
O
O
O
O
O
O
15-краун-5
18-краун-6
73
7
ФИЗИЧЕСКИЕ СВОЙСТВА И СТРОЕНИЕ ПРОСТЫХ ЭФИРОВ
Диметиловый эфир – газ остальные — бесцветные, подвижные, летучие жидкости с
характерным приятным запахом.
Простые эфиры легче воды; низшие — плохо, а высшие — не растворимы в воде. В 100
мл воды растворяется 7,5 г диэтилового эфира.
Длина связи С-О составляет 0,142 нм, дипольный момент 1,2-1,3 D, валентный угол
С-О-С 109-112°,
Диариловые эфиры — твердые вещества, плохо растворимы в воде, легче воды.
Температуры кипения простых эфиров значительно ниже температур кипения
соответствующих спиртов и близки к алканам с таким же числом С-атомов, так как в
эфирах нет межмолекулярной водородной связи.
Ch4OCh4
C2H5OH
Ткип, °С
-24, нет водородных связей
78
83
Химические свойства:
Характерны реакции с участием:
1) О-атома и его неподеленных электронных пар;
2) С-О связи;
3) углеводородного-радикала.
00C
HJ
1. h4C
O
O4
H
2S
.
ц
кон
2. h4C
O
2
C2 H5I
Ch4
нагрев
h4C
C2 H5 OH +
2 C 2 H5 I + h3O
O
O S OH + h3O
O
Ch4
оле
ум
h4C
O
O S O
O
Ch4
+ h3O
93
9
3. h4C
h4C
O
Ch4 + 2 Na
C2H5ONa +
C2H5Na
4. Образование оксониевых соединений:
благодаря наличию неподеленной электронной пары у атома кислорода эфиры могут
присоединять протон или быть донорами электронной плотности, т. е. обладают
основностью.
Основность эфиров проявляется в реакциях с минеральными кислотами или кислотами
Льюиса.
При протонировании эфиров образуются диалкилгидроксониевые соли.
Диалкиловые эфиры растворяются в сильных минеральных кислотах на холоду с
образованием солей диалкилоксония, которые гидролизуются под действием воды.
h4C
O
..
Ch4 + HCl
t°
h4C
+
O H
Cl
—
h4C
катион диэтилоксония
10
3
10
Реакции по углеводородному остатку
В диалкиловых эфирах реакции (например, хлорирование при облучении) идут
по aльфа С-атому, т. к. образующиеся свободные радикалы более стабильны,
чем алкильные.
Диалкиловые эфиры на свету медленно окисляются кислородом воздуха с
образованием гидропероксидов.
Последние при хранении полимеризуются в полимерные пероксиды.
Реакции алкилариловых эфиров по ароматическому кольцу.
Алкокси-группа как электронодонорный заместитель активирует бензольное
кольцо в SE-реакциях, является о-, п-ориентантом (ориентантом I-го рода).
Реакции виниловых эфиров обусловлены наличием поляризованной двойной
углерод-углеродной связи.
Характерны реакции присоединения и полимеризации.
Направление реакции присоединения контролируется неравномерным
распределением электронной плотности вследствие действия +M-эффекта
алкоксигруппы.
11
3
Циклические простые эфиры. Органические окиси.
Эпоксиды.
— окиси
-окиси
— окиси
O
O
R
оксиран
Этиленоксид (>20 млн. т/год): tкип.=10°С,
Енапр.=25 ккал/моль, d=0.897
O
оксетан
тетрагидрофуран
Синтез эпоксидов (оксиранов).
Из галогенгидринов под действием щелочей.
Эпоксидирование алкенов. В лаборатории эту реакцию проводят надкислотами (реакция
Прилежаева, 1908 г. ).
).
В промышленности этиленоксид получают окислением этилена кислородом воздуха в
присутствии серебряного катализатора.
HOCl
h3C
O
HO
KOH
Ch3
Cl
O2
O2 /Ag или надкислота
R
O
этиленоксид
C
OOH (реакция Прилежаева)
12
3
Химические свойства:
Трехчленный цикл оксиранов характеризуется высокой степенью
различных видов напряжений . Кроме того, в трехчленном цикле оксирана
имеются две полярные связи С-О.
Эти факторы обусловливают высокую реакционную способность
оксиранов, которые могут подвергаться атаке электрофилов по О- атому
или нуклеофилов по С-атомам цикла
O
Изомеризация
400 °C
O
через Ch3=CH-OH
или [H+]
Реакция с реактивами Гриньяра
1) RMgX
O
2) h4O+
h4C
H
R
OH
13
3
13
O
+
H X
HO
NH
H+, h3O
Br
OH
HO
OH
C 2H 5
HB
r
3
HO
Nh3
X
O
HO
NH
OH
O
HO
HO
OH
O
. ..
..
ПЭГ
O C2 H5
N
этилцеллозольв
HO
триэтаноламин
OH
14
3
14
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ ПРОСТЫХ ЭФИРОВ
– Диэтиловый эфир
Диэтиловый эфир — бесцветная жидкость с приятным запахом, очень летуч, легко
воспламеняется. Получают из этилового спирта. Плохо растворим в воде (7% при
20°С), легче воды. Применяется как растворитель, в медицине.
– Эфиры этиленгликоля
• Целлозольвы — моноэфиры этиленгликоля RCh3Ch3OH:
R = Ch4, метилцеллозольв;
R = Ch3Ch4, этилцеллозольв.
Целлозольвы — хорошие растворители, особенно для сложных эфиров целлюлозы;
используются для отделки кож, тканей, как присадки к ракетным топливам, в качестве
пластификаторов.
• Диметиловый эфир этиленгликоля (1,2-диметоксиэтан)
Ch4ОCh3Ch3OCh4 является хорошим растворителем.
• Карбитолы — моноалкиловые эфиры диэтиленгликоля, на-пример, нC4H9ОCh3Ch3OCh3Ch3OH — бутилкарбитол.
• Полиглимы — диметиловые эфиры ди- и триэтиленгликоля.
• Диглим — Ch4ОCh3Ch3OCh3Ch3OCh4 — диметиловый эфир диэтиленгликоля;
используется как хороший растворитель, сильно сольватирует катионы
металлов.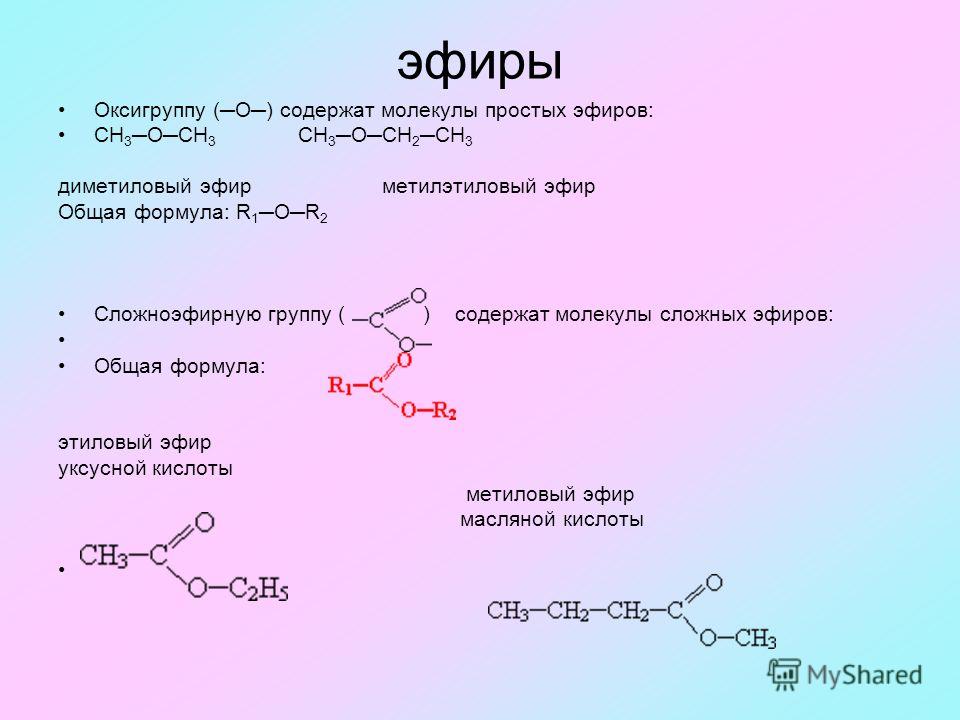
15
3
Органические перекиси
ROOH — гидроперекись алкила
R
ROOR — перекись алкила
O
O
— надкислота, гидроперекись ацила
OOH
O
O
O
— перекись ацила
R
OOCOR
O — перекись бензоила
16
3
16
Получение.
1.Действие спиртов (кислот) на h3O2:
+
h3 O2
R OH
O
h3O2
R
OH — H O
2
O
R O
OH
+ h3O
R
O OH
Окислители при нагревании распадаются до свободных радикалов.
Ch4
h4C
O
Ch4 OH
t°
— OH
O
h4C
t°
O
O
Ch4
.
Ch4
h4C
O
Ch4
— (Ch4)2CO
Ch4
O
2 h4C
Ch4
O
— 2 CO2
O
Инициаторы радикальных процессов и полимеризации
17
3
17
English
Русский
Правила
Итоговая контрольная работа по химии за 10 класс
Итоговый тест по органической химии для 10 класса.
1 вариант
Часть А Выбрать правильный ответ
1. К алканам относится вещество, имеющее общую формулу
К алканам относится вещество, имеющее общую формулу
1) Cnh3n 2) Cnh3n-2 3) Cnh3n+2 4) Cnh3n-6
2. Изомером октана является
1) 2–метил–3–этилпентан 2) 2,3–диметилпентан 3) 3–этилгептан 4) 3–метилоктан
3. Структурная формула вещества 2 – метилпентен – 1 — это
1) СН3 – СН(СН3) – СН2 – СН = СН2 3) СН3 – СН2 – СН2 – С(СН3) = СН2
2) СН2 = С(СН3) – СН2 – СН(СН3) – СН3 4) СН2 = С(СН3) – СН3
4. Этин и ацетилен – это
1) гомологи 2) изомеры 3) одно и то же вещество 4) разные вещества
5. С каким из перечисленных веществ реагирует бензол
1) NaOH 2) HNO3 3) CO2 4) CaO
6. Изомером этанола является
1) метанол 2) диэтиловый эфир 3) диметиловый эфир 4) этилацетат
7. Название, несоответствующее реакции СН3 – СОН + Н2 → С2Н5ОН
1) присоединение 2) гидрирование 3) гидратация 4) восстановление
8. Реакция образования сложных эфиров называется
1) крекинг 2) этерификация 3) дегидратация 4) поликонденсация
9. Оцените правильность суждений.
Оцените правильность суждений.
А. И этан, и этилен могут реагировать с бромом..
Б. И этанол, и фенол могут реагировать с раствором гидроксида натрия.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
10. Формула ацетальдегида
1) СН3ОН 2) СН3СООН 3) НСОН 4) СН3СОН
Часть В (Задания на соотнесение)
11. Установите соответствие между исходными веществами и продуктом реакции
ИСХОДНЫЕ ВЕЩЕСТВА ОСНОВНОЙ ПРОДУКТ РЕАКЦИИ
А) Ch3 = CH – Ch4 + НBr → 1) Ch3Br – Ch3 – Ch4
Б) C2H5Br + NaOH(спирт.р.) → 2) Ch4 – CHBr – Ch4
B) Ch4Br + 2Na → 3) Ch3Br – Ch3Br
Г) C2h5 + Br2 → 4) CHBr2 – Ch4
5) C2h5
6) C2H6
12. Установите соответствие между типом реакции и исходными веществами
ИСХОДНЫЕ ВЕЩЕСТВА ТИП РЕАКЦИИ
А) С6Н6 + Br2 → (в присутствии FeBr3) 1) реакция замещения
Б) C4h20 + Br2 → 2) реакция присоединения
В) C3H8 → 3) реакция окисления
Г) C2h5 + Н2O → 4) реакция дегидрирования
13. Установите соответствие между формулой вещества и классом, к которому оно относится.
Установите соответствие между формулой вещества и классом, к которому оно относится.
ФОРМУЛА ВЕЩЕСТВА КЛАСС СОЕДИНЕНИЙ
А) С2Н5ОН 1) арены
Б) С6Н6 2) алкины
В) НСОН 3) одноатомные спирты
Г) СН2ОН—СН2ОН 4) многоатомные спирты
5) альдегиды
6) карбоновые кислоты
14. Установите соответствие между названием вещества и реактивом, с помощью которого его можно обнаружить.
НАЗВАНИЕ ВЕЩЕСТВА РЕАКТИВ
А) фенол 1) Cu(OH)2
Б) этилен 2) HCl
В) формальдегид 3) CuO
Г) глицерин 4) Br2
5) Ch5
Часть С
15. Написать уравнения реакций, с помощью которых можно осуществить превращения
метан → ацетилен → этаналь → уксусная кислота→ этиловый эфир уксусной кислоты
Используйте только структурные формулы органических веществ.
Итоговый тест по органической химии для 10 класса.
2 вариант
Часть А Выбрать правильный ответ
1. Общая формула гомологического ряда алкенов
Общая формула гомологического ряда алкенов
1) Cnh3n 2) Cnh3n-2 3) Cnh3n+2 4) Cnh3n-6
2. Вещество СН2 – СН2 – СН2 – СН – СН2 – СН2 называется
│ │ │
СН3 СН3 СН3
1) 1,4,6 – тримемилгексан 2) 1,3,6 – триметилгексан 3) 1,3 – диметилгептан 4) 4 – метилоктан
3. Алкины не вступают в реакции
1) гидрирования 2) галогенирования 3) дегидратации 4) гидратации
4. В схеме превращений СН4 → Х → С6Н6 веществом Х является
1) С2Н6 2) С2Н4 3) С2Н2 4) С6Н12
5. С каким из перечисленных веществ не реагирует бензол
1) Cl2 2) HNO3 3) h3 4) h3O
6. Изомером пропанола-1 является
1) этанол 2) метилэтиловый эфир 3) диметиловый эфир 4) этилформиат
7. Продуктом окисления этанола оксидом меди (II) является
1) этаналь 2) муравьиная кислота 3) этиловый эфир уксусной кислоты 4) уксусная кислота
8. Жир образуется в результате взаимодействия
Жир образуется в результате взаимодействия
1) стеариновой кислоты и метанола 2) олеиновой кислоты и этиленгликоля
3) ацетальдегида и глицерина 4) глицерина и пальмитиновой кислоты
9. Оцените правильность суждений.
А.И этилен, и ацетилен могут вступать в реакцию гидратации.
Б. Для обнаружения альдегидов и кетонов можно использовать свежеприготовленный осадок Cu(OH)2.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
10. Формула муравьиной кислоты
1) НСООН 2) СН3СООН 3) НСОН 4) СН3СОН
Часть В (Задания на соотнесение)
11. Установите соответствие между исходными веществами и продуктами реакции
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) С2Н6 → 1) → СО2 + 2Н2О
Б) С2Н6 + Cl2 → 2) → Ch4Cl + HCl
B) Ch5 + 2Cl2 → 3) → C2h5 + h3
Г) C4h20 → 4) → Ch3Cl2 + 2HCl
5) → C2H5Cl + HCl
6) → C2H6 + C2h5
12. Установите соответствие между типом реакции и исходными веществами
ИСХОДНЫЕ ВЕЩЕСТВА ТИП РЕАКЦИИ
А) С6Н6 + Cl2 → (при условии УФ-свет) 1) реакция замещения
Б) C3H6 → 2) реакция присоединения
В) C3H8 + Br2 → 3) реакция окисления
Г) C4H8 + Н2О → 4) реакция дегидрирования
13. Установите соответствие между формулой вещества и классом, к которому оно относится.
Установите соответствие между формулой вещества и классом, к которому оно относится.
ФОРМУЛА ВЕЩЕСТВА КЛАСС СОЕДИНЕНИЙ
А) НСООН 1) алкены
Б) СН 2ОН–СНОН–СН 2ОН 2) алкины
В) С2Н2 3) одноатомные спирты
Г) СН3СОН 4) многоатомные спирты
5) альдегиды
6) карбоновые кислоты
14. Установите соответствие между названием вещества и реактивом, с помощью которого его можно обнаружить.
НАЗВАНИЕ ВЕЩЕСТВА РЕАКТИВ
А) фенол 1) Na2CO3
Б) этилен 2) HCl
В) ацетальдегид 3) KMnO4
Г) уксусная кислота 4) FeCl3
5) Ag2O (аммиачный раствор)
Часть С
15.Написать уравнения реакций, с помощью которых можно осуществить превращения
этилен → этанол → этаналь → уксусная кислота → метиловый эфир уксусной кислоты
Используйте только структурные формулы органических веществ.
Ключ Итоговая контрольная работа 10 класс «Базовый уровень»
№ | Вариант 1 | Балл | № | Вариант 2 | Балл |
1 | 3 | 1 | 1 | 1 | 1 |
2 | 1 | 1 | 2 | 4 | 1 |
3 | 3 | 1 | 3 | 3 | 1 |
4 | 3 | 1 | 4 | 3 | 1 |
5 | 2 | 1 | 5 | 4 | 1 |
6 | 3 | 1 | 6 | 2 | 1 |
7 | 3 | 1 | 7 | 1 | 1 |
8 | 2 | 1 | 8 | 4 | 1 |
9 | 1 | 1 | 9 | 1 | 1 |
10 | 4 | 1 | 10 | 1 | 1 |
11 | 2563 | 2 | 11 | 3546 | 2 |
12 | 1142 | 2 | 12 | 2412 | 2 |
13 | 3154 | 2 | 13 | 6425 | 2 |
14 | 4411 | 2 | 14 | 4351 | 2 |
15 | 1) 2Сh5→CH≡CH+3h3 2) CH≡CH+h3O→Ch4—C=O │ H 3) Ch4—C=O+2Cu(OH)2→ │ H Ch4—C=O + Cu2O+2h3O │ OH 4) Ch4—C=O +C2H5OH → │ OH → Ch4—C=O + h3O │ OC2H5 | 4 | 15 | 1) Ch3=Ch3+h3O→C2H5OH 2) C2H5OH+CuO→ Ch4—C=O + │ H + Cu + h3O 3) ) Ch4—C=O+2Cu(OH)2→ │ H Ch4—C=O + Cu2O+2h3O │ OH 4) Ch4—C=O +Ch4OH → │ OH → Ch4—C=O + h3O │ OCh4 | 4 |
| Всего | 22 |
|
| 22 |
| Критерий оценки 0-9 = 2 10-14 = 3 15-19 = 4 20 – 22 = 5 | ||||
эфиров | Камео Химикаты | NOAA
Добавить в MyChemicals
Страница для печати
Реактивная группа Лист данных
Что такое реактивные группы?
Реакционноспособные группы представляют собой категории химических веществ, которые обычно реагируют сходным образом.
способами, поскольку они сходны по своему химическому строению. Каждое вещество с
лист химических данных был назначен одной или нескольким реакционноспособным группам, и
CAMEO Chemicals использует присвоение реактивных групп, чтобы определить свою реакционную способность.
предсказания.
Подробнее о прогнозах реактивности…
Если вы не можете найти химическое вещество в базе данных, но знаете, какая реактивная группа
он принадлежит — вместо этого вы можете добавить реактивную группу в MyChemicals, чтобы
чтобы увидеть прогнозы реактивности.
Есть
391 химический паспорт
относятся к этой реактивной группе.
Описание
Воспламеняемость
Низкомолекулярные эфиры представляют собой легковоспламеняющиеся газы (диметиловый эфир) или жидкости (метилэтиловый эфир или диэтиловый эфир), которые при испарении и смешивании с воздухом могут образовывать взрывоопасные смеси. Эфиры образуют перекиси при контакте с кислородом или воздухом во время хранения; пероксиды эфира могут детонировать при трении, ударе или нагревании, высвобождая достаточно энергии, чтобы вызвать вторичное возгорание в неперекисном эфире.
Реакционная способность
Эфиры склонны образовывать нестабильные пероксиды при контакте с кислородом. Этиловый, изобутиловый, этилтретбутиловый и этилтретпентиловый эфиры особенно опасны в этом отношении. Пероксиды эфира иногда можно наблюдать в виде прозрачных кристаллов, которые могут быть чувствительными к ударам и осаждаться на контейнерах или на поверхности жидкости. Простые эфиры обычно действуют как слабые основания Льюиса. Они образуют соли с сильными кислотами и комплексы присоединения с кислотами Льюиса. Примером может служить комплекс между диэтиловым эфиром и трифторидом бора. Эфиры могут бурно реагировать с сильными окислителями. В других реакциях, которые обычно включают разрыв связи углерод-кислород, простые эфиры относительно неактивны.
Токсичность
Как группа эфиры умеренно токсичны. Низкомолекулярные эфиры являются мощными быстродействующими наркотиками при вдыхании. Токсические эффекты этих соединений обычно бывают острыми, а не хроническими. Проглатывание одной-двух унций жидкого эфира может привести к летальному исходу.
Проглатывание одной-двух унций жидкого эфира может привести к летальному исходу.
Прочие характеристики
Простые эфиры содержат атом кислорода, связанный с двумя органическими группами, то есть они имеют общую формулу R-O-R’, где R и R’ представляют собой органические группы. Эфиры получают синтезом Вильямсона (реакция алкоксида металла с алкилгалогенидом), а также реакцией алкилгидросульфатов со спиртами. Это сводится к смешиванию спиртов с серной кислотой и нагреванию. Этот процесс дает простые эфиры в качестве побочных продуктов при получении спиртов из олефинов в присутствии H3SO4.
Примеры
Фениловый эфир, этиловый эфир, аллилэтиловый эфир, анизидин, анизол, бутилметиловый эфир, бутилвиниловый эфир, диаллиловый эфир, изопропиловый эфир, дивиниловый эфир, метиловый эфир.
Документация по реактивности
Воспользуйтесь ссылками ниже, чтобы узнать, как эта реактивная группа взаимодействует с любым
реактивных групп в базе данных.
Прогнозируемые опасности и побочные продукты газа для каждой пары реактивных групп будут
отображаться, а также документация и ссылки, которые использовались для
делать прогнозы реактивности.
Смешать Эфиры с:
- Ацетали, кетали, полуацетали и полукетали
- Кислоты карбоновые
- Кислоты сильные неокисляющие
- Кислоты сильные окислители
- Кислоты, слабые
- Акрилаты и акриловые кислоты
- Ацилгалогениды, сульфонилгалогениды и хлорформиаты
- Спирты и полиолы
- Альдегиды
- Алкины с ацетиленовым водородом
- Алкины, не содержащие ацетиленового водорода
- Амиды и имиды
- Амины ароматические
- Амины, фосфины и пиридины
- Ангидриды
- Арилгалогениды
- Азо-, диазо-, азидо-, гидразиновые и азидные соединения
- Базы, Сильные
- Базы, слабые
- Карбаматы
- Карбонатные соли
- Хлорсиланы
- Конъюгированные диены
- Цианиды неорганические
- Соли диазония
- Эпоксиды
- Сложные эфиры, сульфатные эфиры, фосфатные эфиры, тиофосфатные эфиры и боратные эфиры
- Эфиры
- Соли фтора, растворимые
- Фторированные органические соединения
- Галогенированные органические соединения
- Галогенирующие агенты
- Углеводороды алифатические насыщенные
- Углеводороды, алифатические ненасыщенные
- Углеводороды, ароматические
- Недостаточно информации для классификации
- Изоцианаты и изотиоцианаты
- Кетоны
- Гидриды металлов, алкилы металлов, арилы металлов и силаны
- Металлы, щелочи, очень активные
- Металлы, элементальные и порошковые, активные
- Металлы менее химически активные
- Соединения нитратов и нитритов, неорганические
- Нитриды, фосфиды, карбиды и силициды
- Нитрилы
- Нитро, нитрозо, нитраты и нитритные соединения, органические
- Неокислительно-восстановительные неорганические соединения
- Не химически активный
- Металлоорганические соединения
- Окислители, сильные
- Окислители, слабые
- Оксимы
- Пероксиды органические
- Фенольные соли
- Фенолы и крезолы
- Полимеризуемые соединения
- Четвертичные аммониевые и фосфониевые соли
- Восстанавливающие агенты, сильные
- Восстанавливающие агенты, слабые
- Соли кислотные
- Соли основные
- Силоксаны
- Сульфиды неорганические
- Сульфиды органические
- Сульфитные и тиосульфатные соли
- Сульфонаты, фосфонаты и тиофосфонаты, органические
- Сложные эфиры и соли тиокарбамата/ Сложные эфиры и соли дитиокарбамата
- Вода и водные растворы
Эта дата в истории UCSF: взрыв эфира
Воскресенье, 24 марта 2019 г.
Первоначально опубликовано в Synapse — студенческой газете UCSF 30 марта 1995 г. Лаборатория Шетлара на 10-м этаже здания Медицинских наук стала мощным напоминанием всем нам, кто работает в лаборатории или рядом с ней, о том уважении, которое следует оказывать определенным химическим веществам, обычно используемым в рутинных биологических экспериментах.
Окна были выбиты, здание эвакуировали на несколько часов, а проспект Парнас был перекрыт пожарными машинами, что вызвало настоящий переполох в обеденной толпе напротив.
К счастью, Шетлар не был серьезно ранен, и с тех пор дела в его лаборатории пришли в норму; но из этого опыта можно извлечь урок.
Взрыв был вызван реакцией химического диэтилового эфира.
Обычно нереактивная природа эфира делает его полезным растворителем для многих реакций, и именно для этого он в основном используется в лаборатории, особенно в процессе синтеза белка.
Физические свойства диэтилового эфира можно понять, изучив его химическую структуру. Он состоит из молекулы кислорода, соединенной с обеих сторон с двумя двухуглеродными цепями, и связанных с ними атомов водорода, следовательно, диэтила.
Он состоит из молекулы кислорода, соединенной с обеих сторон с двумя двухуглеродными цепями, и связанных с ними атомов водорода, следовательно, диэтила.
Достаточно распространенная структура соединения создает слабые силы притяжения между молекулами, что придает этому эфиру очень низкую температуру кипения, 34,5 градуса по Цельсию, всего лишь примерно на 10 градусов выше нормальной комнатной температуры.
Как поясняется в одном вводном тексте по органической химии: «Одна из важнейших реакций эфиров — нежелательная — реакция с кислородом воздуха с образованием перекисей (автоокисление)».
Реакция представляет собой свободнорадикальный механизм, который включает включение двух дополнительных атомов кислорода из воздуха, связывающих две молекулы эфира кислородно-кислородной связью.
Полученное соединение называется гидропероксидом. Известно, что пероксиды нестабильны, потому что связь 0-0 слаба и легко разрушается при относительно низких температурах.
Реакция самоокисления настолько распространена, что любые эфиры, хранившиеся некоторое время, неизменно содержат перекиси.
Пероксиды очень опасны, потому что они бурно разлагаются при умеренных температурах, активируются слегка повышенной температурой, трением при движении или ударом. Это разложение может привести к взрыву.
Эфир очень летуч, то есть быстро испаряется на воздухе. Однако пероксиды, образующиеся в эфире, не являются летучими и остаются в уменьшающемся уровне жидкости по мере испарения эфира с течением времени, создавая концентрированное вещество, которое может взорваться довольно легко и с большой силой.
9 марта, вспоминает Шетлар, он участвовал в плановой уборке лаборатории, освобождая шкафы для хранения от старых химикатов, которые должны быть утилизированы как химические отходы.
Он наткнулся на две банки эфира в задней части шкафа; банки, насколько ему было известно, стояли там с 1985 года.
Хорошо понимая опасность старого эфира, Шетлар осторожно поставил банки в вытяжной шкаф рядом со шкафом, вентилируя крышки. Он вернулся к работе в кабинете и почти сразу услышал «хлопок» из капота.
Когда он повернулся, чтобы посмотреть, что вызвало звук, произошел взрыв, и он был сбит с ног.
Это все, что он помнит, сказал он Synapse в интервью 28 марта. под душем и тушением начавшегося пожара в капюшоне. Роджер Кук, профессор биохимии, прибежал с другим огнетушителем, чтобы завершить тушение пожара.
«Шетлар считает этих людей героями», — говорит декан фармацевтической школы Джордж Кеньон.
Шетлар не был серьезно ранен; он не потерял сознание и пошел в отделение неотложной помощи Моффита. Он получил несколько порезов от летящего стекла и несколько ожогов от взорвавшейся бутылки с азотной кислотой.
Очки, которые он носил, были сделаны из безопасного стекла и, по словам Кеньона, «почти наверняка спасли ему зрение».
Слух Шетлара не пострадал, предположительно потому, что нарастание давления было одинаковым с обеих сторон его головы. Однако давление внутри лаборатории от взрыва эфира было намного выше, чем снаружи, и всего было выбито 12 окон.
Разбитие окон было предпочтительнее того, что могло бы произойти, если бы их не было; Кеньон и другие рассказывают истории (более масштабных) взрывов эфира в комнатах без окон, в которых стены были выдвинуты наружу на 18 дюймов.
Комитет по безопасности фармацевтической школы и Управление охраны окружающей среды и здоровья (EH&S) расследуют случившееся, и хотя никто не может быть полностью уверен в ходе событий, начинает появляться теория.
Судя по всему, протекал паровой клапан в вытяжке, где стояли старые банки с эфиром. Представители EH&S сообщили Шетлару, что в соседнем вытяжном шкафу были бутылки с эфиром, из-за которых и начался пожар.
Шетлар полагает, что пары из вентилируемых старых банок с эфиром могли воспламениться под воздействием более высоких температур протекающего парового вентиля.
Это пламя, вероятно, зажгло бутылки с эфиром в соседнем вытяжном шкафу, и это эфирное пламя спровоцировало взрыв в старых канистрах.
Владимир Басус, расследующий инцидент для Школы фармации, подчеркивает, что неясно, произошел ли взрыв от перекисей, хотя это могло быть.
Некоторые бутылки с эфиром в соседнем вытяжном шкафу даже не опрокинуты, поэтому маловероятно, что они взорвались. Басус считает, что одна из возможностей состоит в том, что возникший огонь сорвал крышки с банок и выбросил эфир в воздух.
Этот эфир вступил в контакт с более высокой температурой в колпаке из-за пожара и вызвал крупный взрыв. Во всяком случае, в первом вытяжном шкафу, рядом со шкафом, в котором работал Шетлар, находился также баллон с азотной кислотой (ожидавший транспортировки в химические отходы). Эта бутылка взорвалась, разбрызгивая кислоту в непосредственной близости и обжигая его лицо и волосы.
К счастью, никто, кроме Шетлара, не пострадал, и через несколько дней он смог вернуться к работе.
Окна были заменены на следующий день, и за исключением области, непосредственно окружающей вытяжной шкаф, лаборатории не было нанесено никаких повреждений (за исключением плаката с японскими открытками, который был обрызган кислотой). Кеньон был очень доволен сотрудничеством остального персонала здания Медицинских наук в спокойной и быстрой эвакуации.
«EH&S и полиция кампуса очень хорошо справились с ситуацией», — добавляет он.
К счастью, никто, кроме Шетлара, не пострадал, и через несколько дней он смог вернуться к работе.
Окна были заменены на следующий день, и за исключением области, непосредственно окружающей вытяжной шкаф, никаких повреждений лаборатории не было (кроме плаката японских открыток, который был обрызган кислотой).
Кеньон был очень доволен сотрудничеством остального персонала здания Медицинских наук в спокойной и быстрой эвакуации.
«EH&S и полиция кампуса очень хорошо справились с ситуацией», — добавляет он.
Хотя эфир почти повсеместно используется в биологических исследовательских лабораториях, и большинство работников знают, что он легко воспламеняется и его следует держать вдали от открытого огня, тенденция эфира к образованию взрывоопасных соединений при контакте с воздухом не так хорошо известна.
Руководство по безопасности в лабораториях, опубликованное Американским обществом микробиологии, рекомендует хранить эфиры не более трех месяцев, а химические вещества, подозреваемые во взрывоопасности из-за возраста или небрежного обращения, следует передавать специалистам по работе с такими соединениями (наши EH&S ).
