Ацетоуксусный эфир. Ацетоуксусный эфир химические свойства
Ацетоуксусный эфир физические свойства - Справочник химика 21
Физические свойства некоторых ацетоуксусных эфиров [c.613]
Как нам известно (см. стр. 534 сл.), многие физические характеристики вещества могут быть вычислены, если известна формула его строения. Особенно точно может быть вычислена молекулярная рефракция. Исследование плотности, молекулярной рефракции и других физических свойств показало, что величины этих констант для обыкновенного ацетоуксусного эфира лежат между теми, которые теоретически вычисляются для обеих форм. Зная величины этих констант для чистых веществ (на основании вычисления), можно было определить, в каких относительных количествах находятся обе формы. Изменение [c.614]
Изменение физических свойств свежеперегнанного ацетоуксусного эфира, (стр. 520) можно объяснить недостижением равновесия между обеими формами при температуре опыта. [c.527]
Другие факторы также могут оказывать влияние на устойчивость при окислении. Оказалось, что скорость окислительной деструкции некоторых силиконовых смол пропорциональна скорости диффузии кислорода в образец и степени сшивки поверхности [138]. Окислительная деструкция может быть задержана на некоторое время добавлением к полисилоксану небольших количеств противоокислителей, причем их вероятная функция как гасителей свободных радикалов или обрывателей цепи (агенты передачи цепи) заключается в прекращении автокаталитической деструкции, прежде чем она разовьется до такой степени, что значительно изменит заданные физические свойства полимера. Хелатные соединения, например медное хелатное соединение ацетоуксусного эфира [429], различные амины и многоатомные спирты [275] являются примерами таких веществ. [c.206]
Научные исследования охватывают ряд направлений общей химии XIX в. Под руководством А. В. Г. Кольбе получил (1847) пропионовую кислоту омылением этилцианида и, таким образом, разработал способ получения карбоновых кислот из спиртов через нитрилы. При попытке выделить свободные радикалы — метил и этил — получил (1849) цинкал-килы, которые в дальнейшем широко использовались в органическом синтезе. Получив алкильные производные олова и ртути, ввел (1852) термин металлоорганические соединения . Наблюдая способность к насыщению разных элементов и сравнивая органические производные металлов с неорганическими соединениями, ввел (1852) понятие о соединительной силе , явившееся предшественником понятия валентности. Синтезировал (1862) органические производные бора и лития. Разрабатывая методы получения цинкалкилов и используя их в синтезах, получил кислоты — пропионовую, метакри-ловую, различные оксикислоты. Изучал (1864) свойства ацетоуксусного эфира. Обнаружил трех- и пятивалентность азота, фосфора, мышьяка и сурьмы. Исследовал (1861 —1868) влияние атмосферного давления на процесс горения. Результаты своих работ изложил в книге Исследования по чистой, прикладной и физической химии (1877). [c.526]
К сожалению, моноалкилирование редко происходит так однозначно, как это представлено уравнениями (16-19) и (16-20) или (16-21) в тех случаях, когда в продукте моноалкилирования имеются а-водородные атомы, расположенные таким образом, что оказывается возможным диалкилирование. На практике реакция ацетоуксусного эфира (или диэтилмалоната) с 1 молем этилата натрия и 1 молем иодистого метила приводит к трудноразделимой смеси исходного эфира и продуктов его моно- и диметилирования. Лучшие результаты достигаются в тех случаях, когда вводятся алкильные группы большего размера, так как физические свойства исходных веществ и продуктов моно- и диалкилирования при этом существенно различны. Диалкилирование обычно подавляется вследствие большого объема продукта моноалкилирования. [c.489]
Наконец, Кнорру (1911) удалось, растворяя ацетоуксусный эфир в петролейном эфире и охлаждая раствор жидким воздухом, выделить из раствора кристаллическое вещество с т. пл. —39° С, оказавшееся чистой кето-формой, т. е. сс бственно ацетоуксусным эфиром. Свежеприготовленное вещество не давало реакции с хлорным железом, не присоединяло брома и обладало физическими свойствами, точно отвечающими кето-фор-ме. При стоянии расплавленный чистый ацетоуксусный эфир медленно превращается в обыкновенный ацетоуксусный эфир. [c.615]
Получаемый описанным выше способом обыкновенный ацетоуксусный эфир представляет собой жидкость с приятным фруктовым запахом, кипяшую с небольшим разложением при 181°, немного растворимую в воде, смешиваюшуюся со спиртом и эфиром. Удельный вес свежеперегнанного ацетоуксусного эфира несколько отличается от удельного веса этого же вещества после того, как оно постоит некоторое время. Через несколько часов удельный вес его делается постоянным, равным df = 1,0282. Другие физические свойства ацетоуксусного эфира также делаются постоянными лишь после многочасового стояния. [c.520]
chem21.info
Ацетоуксусный эфир - Википедия
Материал из Википедии — свободной энциклопедии
| Ацетоуксусный эфир | |
| Этил-3-оксобутаноат | |
| Этилацетоуксусный эфир,этиловый эфир ацетоуксусной кислоты,этилацетоацетат | |
| Ch4COCh3COOС2Н5 | |
| C6h20O3 | |
| бесцветная жидкость с фруктовым запахом | |
| 130,1418 ± 0,0064 г/моль | |
| 1,0284 г/см³ | |
| -45 °C | |
| 180,8 °C | |
| 84 °C | |
| 304 °C | |
| 9,5 % | |
| 100 Па при 20 °С | |
| 10,68 (в воде),14,2 (в ДМСО) | |
| 2,86 г/100 мл | |
| 1,4198 | |
| 141-97-9 | |
| 8868 | |
| 205-516-1 | |
| AK5250000 | |
| 4893 | |
| 13865426 | |
| 3895 мг/кг (крысы, перорально) | |
| Слаботоксичен, высокотоксичен при действии на кожу, ирритант | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Ацетоуксусный эфир , также этиловый эфир ацетоуксусной кислоты, этилацетоацетат — органическое соединение, сложный эфир, бесцветная подвижная жидкость со своеобразным нерезким запахом. Растворяется в воде (14,3 % при 16,5 °C), смешивается с этанолом и диэтиловым эфиром.
encyclopaedia.bid
Ацетоуксусный эфир - это... Что такое Ацетоуксусный эфир?
Ацетоуксусный эфир(этиловый эфир ацетоуксусной кислоты, этилацетоацетат) - бесцветная подвижная жидкость со своеобразным нерезким запахом. Растворяется в воде (14,3 % при 16,5 °C), смешивается с этанолом и диэтиловым эфиром.
Свойства
Для ацетоуксусного эфира, как и для других 1,3-дикарбонильных соединений характерна кето-енольная таутомерия:
,Енольный таутомер стабилизирован за счет образования внутримолекулярной водородной связи между протоном и соседним карбонильным кислородом. Положение равновесия и, соответственно, соотношение таутомеров зависит от растворителя и температуры. Так, в чистом ацетоуксусном эфире при комнатной температуре концентрация енольной формы составляет 7,5 %. Равновесие сдвигается в сторону енольной формы при уменьшении полярности растворителя, так, при 18 °C доля енольной формы в водном растворе составляет 0,4 %, в диэтиловом эфире — 27,1 %, в циклогексане — 46,4 %.
Кетонная форма ацетоуксусного эфира может быть выделена из равновесной смеси вымораживанием, енольная - вакуумной перегонкой в кварцевой посуде. Скорость установления кето-енольного равновесия зависит от температуры и материала сосуда, чистые таутомеры хранятся в кварцевой посуде при низких температурах (-80°C - охлаждение сухим льдом).
Содержание енольной формы определяется бромометрически: бром практически мгновенно присоединяется по двойной связи енола, что сопровождается исчезновением желто-оранжевой окраски молекулярного брома.
Реакциями енольной формы также обусловлено O-ацилирование ацетоуксусного эфира хлорангидридами карбоновых кислот в пиридине, при этом образуются сложные эфиры β-гидроксикротоновой кислоты:
При взаимодействии с пентахлоридом фосфора гидроксил енольной формы ацетоуксусного эфира замещается на хлор с образованием этилового эфира β-хлоркротоновой кислоты:
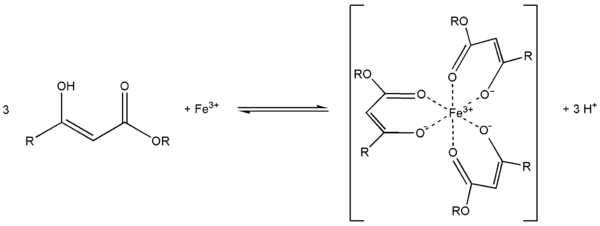
Ch4(HO)C=CHCOOC2H5 + PCl5 Ch4ClC=CHCOOC2H5 + POCl3 + HClС металлами ацетоуксусный эфир образует хелаты, в которых ацетилацетат-анион выступает в роли бидентантного лиганда, так, с солями трехвалентного железа ацетоуксусный эфир образует окрашеный в пурпурный цвет комплекс:
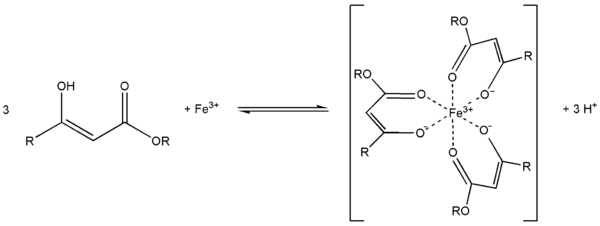
Под действием сильных оснований и щелочных металлов ацетоуксусный эфир депротонируется с образованием резонансно стабилизированный аниона:
Образование натриевой соли ацетилацетата (натрийацетоуксусного эфира) под действием алкоголята натрия - в том числе и под действием этилата натрия, образующегося in situ при действии металлического натрия на ацетоуксусный эфир - широко используется в синтетической практике вследствие высокой нуклеофильности аниона.
Ацетилацетат натрия в реакциях с мягкими электрофилами выступает в роли C-нуклеофила. Так, он легко алкилируется галогеналкилами с образованием соответствующих алкилацетоуксусных эфиров, из которых, в свою очередь, могут быть получены и затем проалкилированы натриевые производные:
Под действием кислот или разбавленных растворов щелочей ацетоуксусный эфир омыляется с образованием нестабильной ацетоуксуслой кислоты, которая м мягких условиях декарбоксилируется с образованием ацетона:
Ch4COCh3COOC2H5 + h3O Ch4COCh3COOH + C2H5OH Ch4COCh3COOH Ch4COCh4 + CO2 + h3OАналогичным образом ведут себя и моно- и дизамещенные ацетоуксусные эфиры, полученные алкилированием натрийацетоуксусного эфира (кетонное расщепление), эта реакция используется для синтеза замещенных метилкетонов.
Иначе протекает взаимодействие ацетоуксусного эфира с концентрированными растворами щелочей: в этом случае протекает отщепление ацетильной группы с образованием двух молекул уксусной кислоты (кислотное расщепление), эта реакция идет и с замещенными ацетоуксусными эфирами и используется для синтеза гомологов уксусной кислоты через алкилпроизводные ацетоуксусного эфира:
Ch4COCHRCOOC2H5 + OH- + h3O Ch4COO- + RCh3COOH + C2H5OH
Синтез
Классическим методом синтеза ацетоуксусного эфира является сложноэфирная конденсации этилацетата в присутствии этанола под действием металлического натрия, катализатором конденсации является образующийся in situ этилат натрия. Образующийся натрийацетоуксусный эфир действием разбавленной минеральной кислоты переводят в ацетоуксусный эфир[1]:
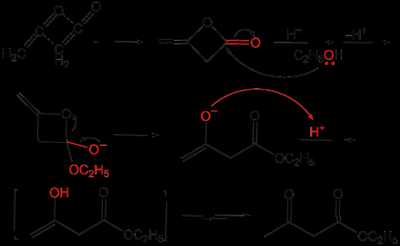
Ацетоуксусный эфир также может быть синтезирован ацилированием этанола дикетеном, этот метод является промышленным методом синтеза:
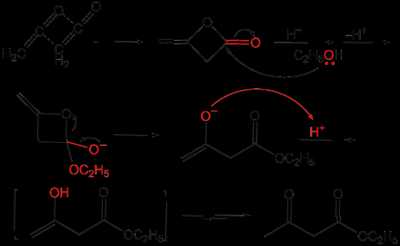
Применение
Ацетоуксусный эфир широко применяется в органическом синтезе. Будучи 1,3-дифункциональным реагентом, он применяется для синтеза гетероциклических соединений. В промышленности применяется в производстве фармацевтических препаратов (пирамидона, акрихина, витамина B1), а также красителей для цветной фотографии, ряда органических веществ.
Биологическое действие
Обладает кожнораздражающим действием. Всасывается через кожу. ПДК 1 мг/м³
Примечания
- ↑ С.В.Пономарев, А.С.Золотарева, Л.Г.Сагинова, В.И.Теренин "Практикум по органической химии"
Ссылки
Ацетоуксусный эфир - это... Что такое Ацетоуксусный эфир?
Ацетоуксусный эфир(этиловый эфир ацетоуксусной кислоты, этилацетоацетат) - бесцветная подвижная жидкость со своеобразным нерезким запахом. Растворяется в воде (14,3 % при 16,5 °C), смешивается с этанолом и диэтиловым эфиром.
Свойства
Для ацетоуксусного эфира, как и для других 1,3-дикарбонильных соединений характерна кето-енольная таутомерия:
,Енольный таутомер стабилизирован за счет образования внутримолекулярной водородной связи между протоном и соседним карбонильным кислородом. Положение равновесия и, соответственно, соотношение таутомеров зависит от растворителя и температуры. Так, в чистом ацетоуксусном эфире при комнатной температуре концентрация енольной формы составляет 7,5 %. Равновесие сдвигается в сторону енольной формы при уменьшении полярности растворителя, так, при 18 °C доля енольной формы в водном растворе составляет 0,4 %, в диэтиловом эфире — 27,1 %, в циклогексане — 46,4 %.
Кетонная форма ацетоуксусного эфира может быть выделена из равновесной смеси вымораживанием, енольная - вакуумной перегонкой в кварцевой посуде. Скорость установления кето-енольного равновесия зависит от температуры и материала сосуда, чистые таутомеры хранятся в кварцевой посуде при низких температурах (-80°C - охлаждение сухим льдом).
Содержание енольной формы определяется бромометрически: бром практически мгновенно присоединяется по двойной связи енола, что сопровождается исчезновением желто-оранжевой окраски молекулярного брома.
Реакциями енольной формы также обусловлено O-ацилирование ацетоуксусного эфира хлорангидридами карбоновых кислот в пиридине, при этом образуются сложные эфиры β-гидроксикротоновой кислоты:
Ch4(HO)C=CHCOOC2H5 + ROCl Ch4(ROO)C=CHCOOC2H5 + HClПри взаимодействии с пентахлоридом фосфора гидроксил енольной формы ацетоуксусного эфира замещается на хлор с образованием этилового эфира β-хлоркротоновой кислоты:
Ch4(HO)C=CHCOOC2H5 + PCl5 Ch4ClC=CHCOOC2H5 + POCl3 + HClС металлами ацетоуксусный эфир образует хелаты, в которых ацетилацетат-анион выступает в роли бидентантного лиганда, так, с солями трехвалентного железа ацетоуксусный эфир образует окрашеный в пурпурный цвет комплекс:
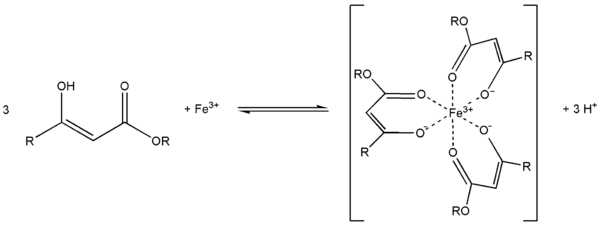
Под действием сильных оснований и щелочных металлов ацетоуксусный эфир депротонируется с образованием резонансно стабилизированный аниона:
Образование натриевой соли ацетилацетата (натрийацетоуксусного эфира) под действием алкоголята натрия - в том числе и под действием этилата натрия, образующегося in situ при действии металлического натрия на ацетоуксусный эфир - широко используется в синтетической практике вследствие высокой нуклеофильности аниона.
Ацетилацетат натрия в реакциях с мягкими электрофилами выступает в роли C-нуклеофила. Так, он легко алкилируется галогеналкилами с образованием соответствующих алкилацетоуксусных эфиров, из которых, в свою очередь, могут быть получены и затем проалкилированы натриевые производные:
Ch4COCh3COOC2H5 + EtONa Ch4COCH-COOC2H5 Na+ + EtOH Ch4COCH-COOC2H5 Na+ + RHal Ch4COCHRCOOC2H5 + NaHalПод действием кислот или разбавленных растворов щелочей ацетоуксусный эфир омыляется с образованием нестабильной ацетоуксуслой кислоты, которая м мягких условиях декарбоксилируется с образованием ацетона:
Ch4COCh3COOC2H5 + h3O Ch4COCh3COOH + C2H5OH Ch4COCh3COOH Ch4COCh4 + CO2 + h3OАналогичным образом ведут себя и моно- и дизамещенные ацетоуксусные эфиры, полученные алкилированием натрийацетоуксусного эфира (кетонное расщепление), эта реакция используется для синтеза замещенных метилкетонов.
Иначе протекает взаимодействие ацетоуксусного эфира с концентрированными растворами щелочей: в этом случае протекает отщепление ацетильной группы с образованием двух молекул уксусной кислоты (кислотное расщепление), эта реакция идет и с замещенными ацетоуксусными эфирами и используется для синтеза гомологов уксусной кислоты через алкилпроизводные ацетоуксусного эфира:
Ch4COCHRCOOC2H5 + OH- + h3O Ch4COO- + RCh3COOH + C2H5OHСинтез
Классическим методом синтеза ацетоуксусного эфира является сложноэфирная конденсации этилацетата в присутствии этанола под действием металлического натрия, катализатором конденсации является образующийся in situ этилат натрия. Образующийся натрийацетоуксусный эфир действием разбавленной минеральной кислоты переводят в ацетоуксусный эфир[1]:
Ацетоуксусный эфир также может быть синтезирован ацилированием этанола дикетеном, этот метод является промышленным методом синтеза:
Применение
Ацетоуксусный эфир широко применяется в органическом синтезе. Будучи 1,3-дифункциональным реагентом, он применяется для синтеза гетероциклических соединений. В промышленности применяется в производстве фармацевтических препаратов (пирамидона, акрихина, витамина B1), а также красителей для цветной фотографии, ряда органических веществ.
Биологическое действие
Обладает кожнораздражающим действием. Всасывается через кожу. ПДК 1 мг/м³
Примечания
- ↑ С.В.Пономарев, А.С.Золотарева, Л.Г.Сагинова, В.И.Теренин "Практикум по органической химии"
Ссылки
med.academic.ru
Ацетоуксусный эфир - это... Что такое Ацетоуксусный эфир?
Ацетоуксусный эфир(этиловый эфир ацетоуксусной кислоты, этилацетоацетат) - бесцветная подвижная жидкость со своеобразным нерезким запахом. Растворяется в воде (14,3 % при 16,5 °C), смешивается с этанолом и диэтиловым эфиром.
Свойства
Для ацетоуксусного эфира, как и для других 1,3-дикарбонильных соединений характерна кето-енольная таутомерия:
,Енольный таутомер стабилизирован за счет образования внутримолекулярной водородной связи между протоном и соседним карбонильным кислородом. Положение равновесия и, соответственно, соотношение таутомеров зависит от растворителя и температуры. Так, в чистом ацетоуксусном эфире при комнатной температуре концентрация енольной формы составляет 7,5 %. Равновесие сдвигается в сторону енольной формы при уменьшении полярности растворителя, так, при 18 °C доля енольной формы в водном растворе составляет 0,4 %, в диэтиловом эфире — 27,1 %, в циклогексане — 46,4 %.
Кетонная форма ацетоуксусного эфира может быть выделена из равновесной смеси вымораживанием, енольная - вакуумной перегонкой в кварцевой посуде. Скорость установления кето-енольного равновесия зависит от температуры и материала сосуда, чистые таутомеры хранятся в кварцевой посуде при низких температурах (-80°C - охлаждение сухим льдом).
Содержание енольной формы определяется бромометрически: бром практически мгновенно присоединяется по двойной связи енола, что сопровождается исчезновением желто-оранжевой окраски молекулярного брома.
Реакциями енольной формы также обусловлено O-ацилирование ацетоуксусного эфира хлорангидридами карбоновых кислот в пиридине, при этом образуются сложные эфиры β-гидроксикротоновой кислоты:
Ch4(HO)C=CHCOOC2H5 + ROCl Ch4(ROO)C=CHCOOC2H5 + HClПри взаимодействии с пентахлоридом фосфора гидроксил енольной формы ацетоуксусного эфира замещается на хлор с образованием этилового эфира β-хлоркротоновой кислоты:
Ch4(HO)C=CHCOOC2H5 + PCl5 Ch4ClC=CHCOOC2H5 + POCl3 + HClС металлами ацетоуксусный эфир образует хелаты, в которых ацетилацетат-анион выступает в роли бидентантного лиганда, так, с солями трехвалентного железа ацетоуксусный эфир образует окрашеный в пурпурный цвет комплекс:
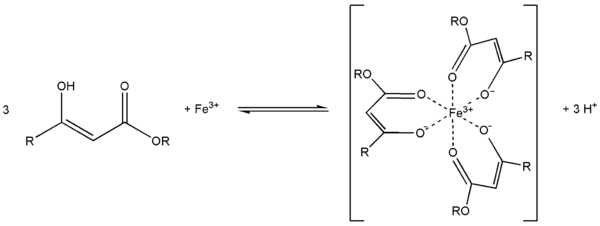
Под действием сильных оснований и щелочных металлов ацетоуксусный эфир депротонируется с образованием резонансно стабилизированный аниона:
Образование натриевой соли ацетилацетата (натрийацетоуксусного эфира) под действием алкоголята натрия - в том числе и под действием этилата натрия, образующегося in situ при действии металлического натрия на ацетоуксусный эфир - широко используется в синтетической практике вследствие высокой нуклеофильности аниона.
Ацетилацетат натрия в реакциях с мягкими электрофилами выступает в роли C-нуклеофила. Так, он легко алкилируется галогеналкилами с образованием соответствующих алкилацетоуксусных эфиров, из которых, в свою очередь, могут быть получены и затем проалкилированы натриевые производные:
Ch4COCh3COOC2H5 + EtONa Ch4COCH-COOC2H5 Na+ + EtOH Ch4COCH-COOC2H5 Na+ + RHal Ch4COCHRCOOC2H5 + NaHalПод действием кислот или разбавленных растворов щелочей ацетоуксусный эфир омыляется с образованием нестабильной ацетоуксуслой кислоты, которая м мягких условиях декарбоксилируется с образованием ацетона:
Ch4COCh3COOC2H5 + h3O Ch4COCh3COOH + C2H5OH Ch4COCh3COOH Ch4COCh4 + CO2 + h3OАналогичным образом ведут себя и моно- и дизамещенные ацетоуксусные эфиры, полученные алкилированием натрийацетоуксусного эфира (кетонное расщепление), эта реакция используется для синтеза замещенных метилкетонов.
Иначе протекает взаимодействие ацетоуксусного эфира с концентрированными растворами щелочей: в этом случае протекает отщепление ацетильной группы с образованием двух молекул уксусной кислоты (кислотное расщепление), эта реакция идет и с замещенными ацетоуксусными эфирами и используется для синтеза гомологов уксусной кислоты через алкилпроизводные ацетоуксусного эфира:
Ch4COCHRCOOC2H5 + OH- + h3O Ch4COO- + RCh3COOH + C2H5OHСинтез
Классическим методом синтеза ацетоуксусного эфира является сложноэфирная конденсации этилацетата в присутствии этанола под действием металлического натрия, катализатором конденсации является образующийся in situ этилат натрия. Образующийся натрийацетоуксусный эфир действием разбавленной минеральной кислоты переводят в ацетоуксусный эфир[1]:
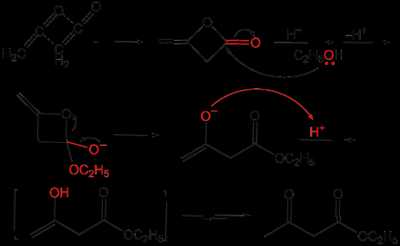
Ацетоуксусный эфир также может быть синтезирован ацилированием этанола дикетеном, этот метод является промышленным методом синтеза:
Применение
Ацетоуксусный эфир широко применяется в органическом синтезе. Будучи 1,3-дифункциональным реагентом, он применяется для синтеза гетероциклических соединений. В промышленности применяется в производстве фармацевтических препаратов (пирамидона, акрихина, витамина B1), а также красителей для цветной фотографии, ряда органических веществ.
Биологическое действие
Обладает кожнораздражающим действием. Всасывается через кожу. ПДК 1 мг/м³
Примечания
- ↑ С.В.Пономарев, А.С.Золотарева, Л.Г.Сагинова, В.И.Теренин "Практикум по органической химии"
Ссылки
veter.academic.ru
Ацетоуксусный эфир - это... Что такое Ацетоуксусный эфир?
Ацетоуксусный эфир(этиловый эфир ацетоуксусной кислоты, этилацетоацетат) - бесцветная подвижная жидкость со своеобразным нерезким запахом. Растворяется в воде (14,3 % при 16,5 °C), смешивается с этанолом и диэтиловым эфиром.
Свойства
Для ацетоуксусного эфира, как и для других 1,3-дикарбонильных соединений характерна кето-енольная таутомерия:
,Енольный таутомер стабилизирован за счет образования внутримолекулярной водородной связи между протоном и соседним карбонильным кислородом. Положение равновесия и, соответственно, соотношение таутомеров зависит от растворителя и температуры. Так, в чистом ацетоуксусном эфире при комнатной температуре концентрация енольной формы составляет 7,5 %. Равновесие сдвигается в сторону енольной формы при уменьшении полярности растворителя, так, при 18 °C доля енольной формы в водном растворе составляет 0,4 %, в диэтиловом эфире — 27,1 %, в циклогексане — 46,4 %.
Кетонная форма ацетоуксусного эфира может быть выделена из равновесной смеси вымораживанием, енольная - вакуумной перегонкой в кварцевой посуде. Скорость установления кето-енольного равновесия зависит от температуры и материала сосуда, чистые таутомеры хранятся в кварцевой посуде при низких температурах (-80°C - охлаждение сухим льдом).
Содержание енольной формы определяется бромометрически: бром практически мгновенно присоединяется по двойной связи енола, что сопровождается исчезновением желто-оранжевой окраски молекулярного брома.
Реакциями енольной формы также обусловлено O-ацилирование ацетоуксусного эфира хлорангидридами карбоновых кислот в пиридине, при этом образуются сложные эфиры β-гидроксикротоновой кислоты:
Ch4(HO)C=CHCOOC2H5 + ROCl Ch4(ROO)C=CHCOOC2H5 + HClПри взаимодействии с пентахлоридом фосфора гидроксил енольной формы ацетоуксусного эфира замещается на хлор с образованием этилового эфира β-хлоркротоновой кислоты:
Ch4(HO)C=CHCOOC2H5 + PCl5 Ch4ClC=CHCOOC2H5 + POCl3 + HClС металлами ацетоуксусный эфир образует хелаты, в которых ацетилацетат-анион выступает в роли бидентантного лиганда, так, с солями трехвалентного железа ацетоуксусный эфир образует окрашеный в пурпурный цвет комплекс:
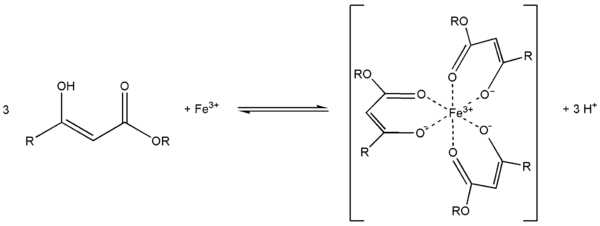
Под действием сильных оснований и щелочных металлов ацетоуксусный эфир депротонируется с образованием резонансно стабилизированный аниона:
Образование натриевой соли ацетилацетата (натрийацетоуксусного эфира) под действием алкоголята натрия - в том числе и под действием этилата натрия, образующегося in situ при действии металлического натрия на ацетоуксусный эфир - широко используется в синтетической практике вследствие высокой нуклеофильности аниона.
Ацетилацетат натрия в реакциях с мягкими электрофилами выступает в роли C-нуклеофила. Так, он легко алкилируется галогеналкилами с образованием соответствующих алкилацетоуксусных эфиров, из которых, в свою очередь, могут быть получены и затем проалкилированы натриевые производные:
Ch4COCh3COOC2H5 + EtONa Ch4COCH-COOC2H5 Na+ + EtOH Ch4COCH-COOC2H5 Na+ + RHal Ch4COCHRCOOC2H5 + NaHalПод действием кислот или разбавленных растворов щелочей ацетоуксусный эфир омыляется с образованием нестабильной ацетоуксуслой кислоты, которая м мягких условиях декарбоксилируется с образованием ацетона:
Ch4COCh3COOC2H5 + h3O Ch4COCh3COOH + C2H5OH Ch4COCh3COOH Ch4COCh4 + CO2 + h3OАналогичным образом ведут себя и моно- и дизамещенные ацетоуксусные эфиры, полученные алкилированием натрийацетоуксусного эфира (кетонное расщепление), эта реакция используется для синтеза замещенных метилкетонов.
Иначе протекает взаимодействие ацетоуксусного эфира с концентрированными растворами щелочей: в этом случае протекает отщепление ацетильной группы с образованием двух молекул уксусной кислоты (кислотное расщепление), эта реакция идет и с замещенными ацетоуксусными эфирами и используется для синтеза гомологов уксусной кислоты через алкилпроизводные ацетоуксусного эфира:
Ch4COCHRCOOC2H5 + OH- + h3O Ch4COO- + RCh3COOH + C2H5OHСинтез
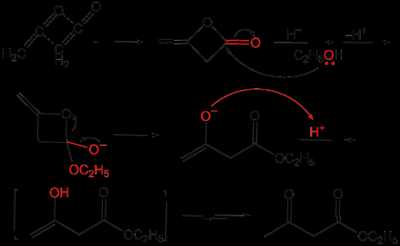
Классическим методом синтеза ацетоуксусного эфира является сложноэфирная конденсации этилацетата в присутствии этанола под действием металлического натрия, катализатором конденсации является образующийся in situ этилат натрия. Образующийся натрийацетоуксусный эфир действием разбавленной минеральной кислоты переводят в ацетоуксусный эфир[1]:
Ацетоуксусный эфир также может быть синтезирован ацилированием этанола дикетеном, этот метод является промышленным методом синтеза:
Применение
Ацетоуксусный эфир широко применяется в органическом синтезе. Будучи 1,3-дифункциональным реагентом, он применяется для синтеза гетероциклических соединений. В промышленности применяется в производстве фармацевтических препаратов (пирамидона, акрихина, витамина B1), а также красителей для цветной фотографии, ряда органических веществ.
Биологическое действие
Обладает кожнораздражающим действием. Всасывается через кожу. ПДК 1 мг/м³
Примечания
- ↑ С.В.Пономарев, А.С.Золотарева, Л.Г.Сагинова, В.И.Теренин "Практикум по органической химии"
Ссылки
biograf.academic.ru
Ацетоуксусный эфир - это... Что такое Ацетоуксусный эфир?
Ацетоуксусный эфир(этиловый эфир ацетоуксусной кислоты, этилацетоацетат) - бесцветная подвижная жидкость со своеобразным нерезким запахом. Растворяется в воде (14,3 % при 16,5 °C), смешивается с этанолом и диэтиловым эфиром.
Свойства
Для ацетоуксусного эфира, как и для других 1,3-дикарбонильных соединений характерна кето-енольная таутомерия:
,Енольный таутомер стабилизирован за счет образования внутримолекулярной водородной связи между протоном и соседним карбонильным кислородом. Положение равновесия и, соответственно, соотношение таутомеров зависит от растворителя и температуры. Так, в чистом ацетоуксусном эфире при комнатной температуре концентрация енольной формы составляет 7,5 %. Равновесие сдвигается в сторону енольной формы при уменьшении полярности растворителя, так, при 18 °C доля енольной формы в водном растворе составляет 0,4 %, в диэтиловом эфире — 27,1 %, в циклогексане — 46,4 %.
Кетонная форма ацетоуксусного эфира может быть выделена из равновесной смеси вымораживанием, енольная - вакуумной перегонкой в кварцевой посуде. Скорость установления кето-енольного равновесия зависит от температуры и материала сосуда, чистые таутомеры хранятся в кварцевой посуде при низких температурах (-80°C - охлаждение сухим льдом).
Содержание енольной формы определяется бромометрически: бром практически мгновенно присоединяется по двойной связи енола, что сопровождается исчезновением желто-оранжевой окраски молекулярного брома.
Реакциями енольной формы также обусловлено O-ацилирование ацетоуксусного эфира хлорангидридами карбоновых кислот в пиридине, при этом образуются сложные эфиры β-гидроксикротоновой кислоты:
Ch4(HO)C=CHCOOC2H5 + ROCl Ch4(ROO)C=CHCOOC2H5 + HClПри взаимодействии с пентахлоридом фосфора гидроксил енольной формы ацетоуксусного эфира замещается на хлор с образованием этилового эфира β-хлоркротоновой кислоты:
Ch4(HO)C=CHCOOC2H5 + PCl5 Ch4ClC=CHCOOC2H5 + POCl3 + HClС металлами ацетоуксусный эфир образует хелаты, в которых ацетилацетат-анион выступает в роли бидентантного лиганда, так, с солями трехвалентного железа ацетоуксусный эфир образует окрашеный в пурпурный цвет комплекс:
Под действием сильных оснований и щелочных металлов ацетоуксусный эфир депротонируется с образованием резонансно стабилизированный аниона:
Образование натриевой соли ацетилацетата (натрийацетоуксусного эфира) под действием алкоголята натрия - в том числе и под действием этилата натрия, образующегося in situ при действии металлического натрия на ацетоуксусный эфир - широко используется в синтетической практике вследствие высокой нуклеофильности аниона.
Ацетилацетат натрия в реакциях с мягкими электрофилами выступает в роли C-нуклеофила. Так, он легко алкилируется галогеналкилами с образованием соответствующих алкилацетоуксусных эфиров, из которых, в свою очередь, могут быть получены и затем проалкилированы натриевые производные:
Ch4COCh3COOC2H5 + EtONa Ch4COCH-COOC2H5 Na+ + EtOH Ch4COCH-COOC2H5 Na+ + RHal Ch4COCHRCOOC2H5 + NaHalПод действием кислот или разбавленных растворов щелочей ацетоуксусный эфир омыляется с образованием нестабильной ацетоуксуслой кислоты, которая м мягких условиях декарбоксилируется с образованием ацетона:
Ch4COCh3COOC2H5 + h3O Ch4COCh3COOH + C2H5OH Ch4COCh3COOH Ch4COCh4 + CO2 + h3OАналогичным образом ведут себя и моно- и дизамещенные ацетоуксусные эфиры, полученные алкилированием натрийацетоуксусного эфира (кетонное расщепление), эта реакция используется для синтеза замещенных метилкетонов.
Иначе протекает взаимодействие ацетоуксусного эфира с концентрированными растворами щелочей: в этом случае протекает отщепление ацетильной группы с образованием двух молекул уксусной кислоты (кислотное расщепление), эта реакция идет и с замещенными ацетоуксусными эфирами и используется для синтеза гомологов уксусной кислоты через алкилпроизводные ацетоуксусного эфира:
Ch4COCHRCOOC2H5 + OH- + h3O Ch4COO- + RCh3COOH + C2H5OHСинтез
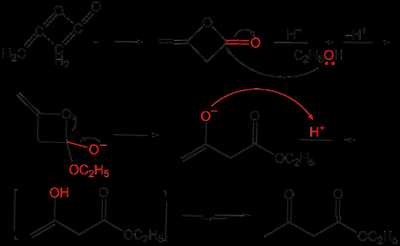
Классическим методом синтеза ацетоуксусного эфира является сложноэфирная конденсации этилацетата в присутствии этанола под действием металлического натрия, катализатором конденсации является образующийся in situ этилат натрия. Образующийся натрийацетоуксусный эфир действием разбавленной минеральной кислоты переводят в ацетоуксусный эфир[1]:
Ацетоуксусный эфир также может быть синтезирован ацилированием этанола дикетеном, этот метод является промышленным методом синтеза:
Применение
Ацетоуксусный эфир широко применяется в органическом синтезе. Будучи 1,3-дифункциональным реагентом, он применяется для синтеза гетероциклических соединений. В промышленности применяется в производстве фармацевтических препаратов (пирамидона, акрихина, витамина B1), а также красителей для цветной фотографии, ряда органических веществ.
Биологическое действие
Обладает кожнораздражающим действием. Всасывается через кожу. ПДК 1 мг/м³
Примечания
- ↑ С.В.Пономарев, А.С.Золотарева, Л.Г.Сагинова, В.И.Теренин "Практикум по органической химии"
Ссылки
dis.academic.ru